KABARPANDEGLANG.COM – Suatu zat dapat dibagi-bagi menjadi bagian-bagian (partikel) yang ukuran partikelnya lebih kecil. Partikel terkecil dari suatu zat yang masih memiliki sifat sama dengan sifat asal partikel itu disebut molekul.
Senyawa dari molekul ini mampu berupa ikatan antara unsur yang sama (molekul unsure), tetapi mampu juga berupa ikatan antara unsure-unsur yang berbeda (molekul senyawa). Jika suatu senyawa dielektrolisis dengan arus listrik searah maka akan terionisasi. Partikel dari senyawa yang terionisasi ini disebut ion.
A. Pengertian Ion
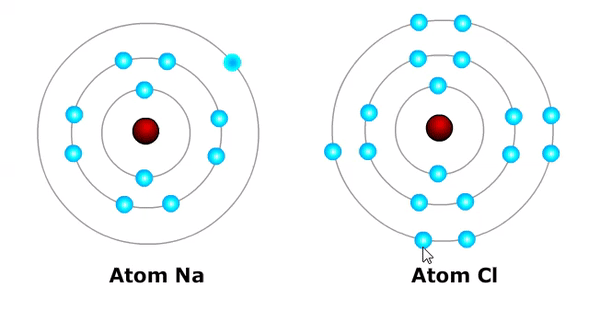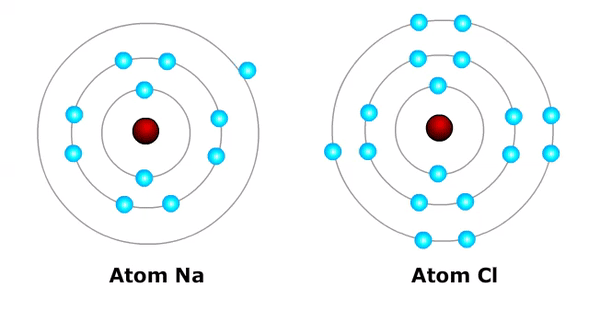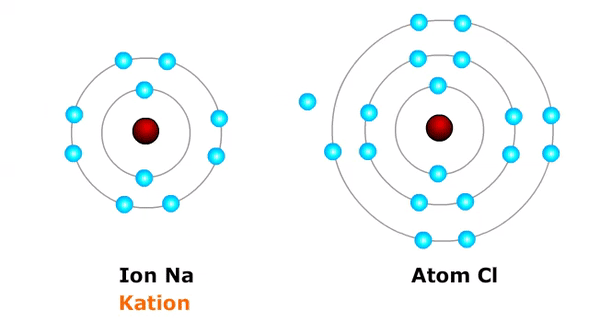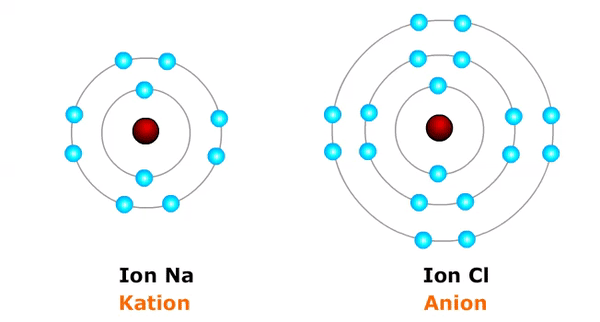
Atom selain bergabung membentuk molekul mampu juga membentuk ion. Ion ialah atom atau kelompok atom yang bermuatan listrik. Ion dibedakan menjadi dua, yaitu ion yang bermuatan listrik nyata disebut kation dan ion yang bermuatan listrik negatif disebut anion.
B. Struktur Ion
Pada keadaan normal, suatu atom tidak bermuatan atau netral. Ion suatu atom akan terbentuk ketika atom melepas atau mendapatkan elektron.
Ion aktual atau kation terbentuk ketika sebuah atom kehilangan atau melepaskan elektron, teladan:
- Na → Na⁺ + e⁻ (atom natrium Na, melepaskan satu elektron menjadi ion natrium bermuatan positip satu = Na+)
- Mg → Mg²⁺ + 2e⁻ (atom magnesium Mg, melepaskan dua elektron menjadi ion magnesium bermuatan dua positip = Mg²⁺)
Ion negatif atau anion terbentuk dikala sebuah atom mendapatkan atau menerima pemanis elektron, teladan:
- Cl + e⁻ → Cl⁻ (atom klorin mendapatkan satu elektron menjadi ion klorin bermuatan negatip satu = Cl⁻)
- O + 2e⁻ → O2⁻ (atom oksigen menerima dua elektron menjadi ion oksigen bermuatan dua negatif = O²⁻).
Elektron yang mengelilingi inti atom terus bergerak sambil berputar pada sumbunya. Akan tetapi, elektron mampu meninggalkan atom karena suatu hal, seperti pemanasan, medan listrik, dan medan magnet. Elektron yang keluar dari suatu atom mampu masuk ke atom lainnya.
Akibatnya, atom yang kehilangan elektron akan menjadi atom yang bermuatan listrik konkret (ion nyata/kation) alasannya jumlah proton menjadi lebih besar daripada jumlah elektronnya, sedangkan atom yang kedatangan elektron menjadi atom bermuatan listrik negatif (ion negatif/ anoda) alasannya jumlah elektronnya melebihi jumlah protonnya.
Peristiwa terurainya suatu zat menjadi ion-ion disebut ionisasi. Hasil ionisasi disebut ion. Elektron yang mampu keluar atau masuk ke suatu atom yaitu elektron yang berada di kulit terluar.
Ionisasi atom hanya terjadi pada atom-atom yang jumlah elektronnya sama dengan 8, 18, atau 32. Atom-atom yang jumlah elektronnya sama dengan bilangan-bilangan tersebut sangat sukar terionisasi sehingga disebut unsur gas mulia.
Jumlah electron yang terlepas atau masuk tergantung pada jumlah elektron pada kulit terluar dengan ketentuan sebagai berikut:
- Jika jumlah electron terluar kurang dari 4 elektron maka atom ini cenderung melepaskan elektron.
- Jika jumlah elektron terluar antara 4 dan 8 maka atom ini cenderung mendapatkan elektron, jumlah electron yang diterima atau dilepaskan membuat jumlah electron di kulit itu menjadi 8.
- Jika jumlah elektron pada kulit terluar sama dengan 4 maka atom ini dapat melepas atau mendapatkan elektron, tergantung dengan unsur apa atom itu berinteraksi.
- Jika jumlah elektron pada kulit terluar sama dengan 8 maka atom itu sangat sukar melepas maupun mendapatkan elektron. Dengan kata lain atom tersebut stabil.
Beberapa contoh kation dan anion mampu kau lihat pada tabel berikut ini.
| Kation | Nama | Anion | Nama |
|---|---|---|---|
| Na+ | Ion natrium | Cl– | Ion klorida |
| Mg2+ | Ion magnesium | O2- | Ion oksida |
| Al3+ | Ion aluminium | S2- | Ion sulfide |
| H+ | Ion hidrogen | I– | Ion iodide |
| K+ | Ion kalium | CO32⁻ | Ion karbonat |
C. Senyawa Ion
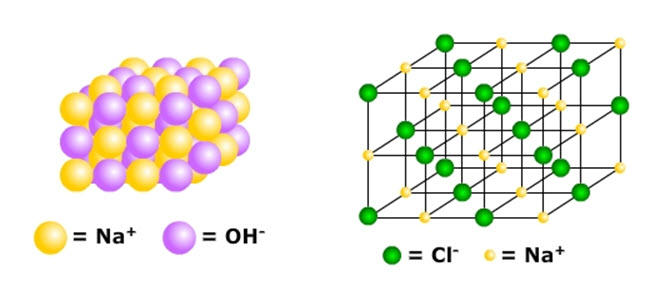
Suatu senyawa yang terusun dari ion-ion dinamakan senyawa ion. Contoh senyawa ion adalah soda api (natrium hidroksida = NaOH) yang tersusun dari ion kasatmata natrium (Na+) dan ion negatif hidroksida (OH-).
Contoh lain senyawa ion yaitu garam dapur (natrium klorida = NaCl). Jika garam dapur dilarutkan dalam air, maka akan terionisasi menjadi ion kasatmata natrium (Na⁺)dan ion negatif klorida (Cl⁻).
Contoh penggabungan antara ion-ion positif dan ion-ion negatif beberapa senyawa ion lainnya diperlihatkan oleh tabel berikut:
| Ion Positif→ | SO₄²⁻ | NO₃⁻ |
|---|---|---|
| Ion Negatif ↓ | ||
| Na⁺ (Natrium) | Na₂SO₄ | NaNO₃ |
| Ca²⁺(Kalsium) | CaSO₄ | Ca(NO₃)₂ |
| Al³⁺(Aluminium) | Al₂(SO₄)₃ | Al(NO₃)₃ |
Terima kasih telah membaca artikel di website kabarpandeglang.com, semoga bisa memberikan informasi yang bermanfaat bagi kamu dan bisa dijadikan referensi. Artikel ini telah dimuat pada kategori pendididkan https://kabarpandeglang.com/topik/pendidikan/, Jangan lupa share ya jika artikelnya bermanfaat. Salam admin ganteng..!!