KABARPANDEGLANG.COM – Senyawa asam dan basa terdiri dari 2 jenis, yakni asam berpengaruh dan asam lemah serta basa besar lengan berkuasa dan basa lemah, sedangkan senyawa garam terdiri dari 3 jenis, adalah garam yang bersifat asam,garam yang bersifat basa dan garam yang bersifat netral. Berikut ini penjelasan mengenai ciri-ciri asam, basa, dan garam.
A. Ciri-ciri Asam, Basa, Garam
Sifat larutan mampu dikelompokan menjadi tiga, yakni larutan asam, basa dan garam. Berikut ini ialah ciri-ciri dari ketiga sifat larutan tersebut
1. Ciri-ciri Asam
Kata asam (acid) berasal dari bahasa Latin acidus yang berarti memiliki rasa asam. Salah satu definisi asam yaitu zat yang jika dilarutkan di dalam air akan menghasilkan ion hidrogen (H⁺). Secara umum asam mempunyai ciri-ciri sebagai berikut:
- Rasa masam bila dicicipi (jangan menguji asam besar lengan berkuasa dengan mencicipinya)
- Derajat keasaman lebih kecil dari 7 (pH < 7)
- Terasa menyengat kalau disentuh, terutama asam berpengaruh
- Reaksi dengan logam bersifat korosif (menimbulkan karat, mampu pula merusak jaringan kulit/iritasi dan melubangi benda yang terbuat dari kayu atau kertas jikalau konsentrasinya tinggi)
- Merupakan larutan elektrolit sehingga dapat menghantarkan arus listrik.
2. Ciri-ciri Basa
Basa (alkali) berasal dari bahasa Arab yang berarti abu. Salah satu definisi basa ialah zat yang bila dilarutkan di dalam air akan menghasilkan ion hidroksida (OH⁻). Secara umum basa mempunyai ciri-ciri sebagai berikut:
- Rasa pahit jika dicicipi
- Dalam keadaan murni umumnya berupa kristal padat
- Tingkat keasaman lebih besar dari 7 (pH > 7)
- Terasa licin di kulit (jangan menguji basa kuat dengan menyentuhnya)
- Memiliki sifat kaustik yaitu merusak kulit jika kadar basanya tinggi
- Dapat mengemulsi minyak
- Merupakan elektrolit, larutannya dapat menghantarkan arus listrik
3. Ciri-ciri Garam
Apabila larutan asam dengan larutan basa direaksikan, maka ion H+ (dari asam) akan bereaksi dengan ion OH- (dari basa) membentuk air. Reaksi antara asam dan basa ini disebut reaksi penetralan (netralisasi) jikalau jumlah zat asam sama dengan jumlah zat basa.
Disebut demikian karena selain air, dihasilkan pula suatu zat yang bersifat netral adalah garam, kalau jumlah asam dan jumlah basanya memiliki perbandingan yang sama. Reaksi ini juga di kenal dengan reaksi penggaraman alasannya adalah menghasilkan garam.
Garam terdapat dalam bentuk garam netral, garam basa dan garam asam. Umumnya garam gampang larut dalam air, merupakan padatan pada suhu kamar (25⁰C), merupakan elektrolit sehingga dapat menghantarkan arus listrik, memiliki titik didih dan titik leleh yang tinggi.
B. Contoh Asam, Basa, Garam
1. Contoh Asam
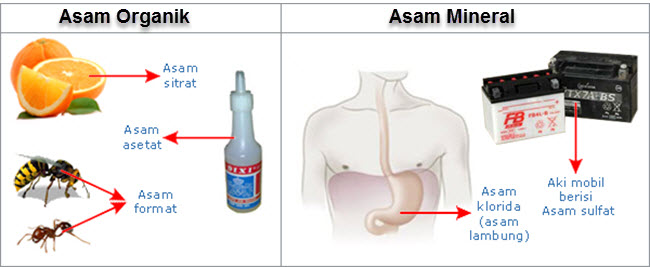
Asam mampu dengan gampang kita temui dalam kehidupan sehari-hari. Dalam kuliner, minuman, buah-buahan, air hujan bahkan di dalam badan kita. Berdasarkan asalnya, asam dikelompokkan menjadi 2 kelompok, adalah asam organik dan asam mineral.
Asam organik berasal dari sumber alami (flora dan hewan), umumnya bersifat asam lemah. Contoh asam organik yaitu asam sitrat terdapat dalam buah jeruk, asam format terdapat dalam gigitan/sengatan semut dan sengatan lebah dan asam asetat yang terdapat dalam cuka makan.
Asam mineral yaitu senyawa asam seperti asam klorida (asam lambung) terdapat dalam sistem pencernaan insan dan hewan. Asam mineral banyak juga dimanfaatkan oleh insan untuk memenuhi kebutuhan sehari-hari dan umumnya bersifat asam besar lengan berkuasa.
Contoh asam mineral ialah asam klorida yang digunakan secara luas dalam industri, asam sulfat untuk aki mobil dan asam fluorida yang biasanya digunakan pada pabrik kaca.
1. Contoh-contoh Asam
Berdasarkan kekuatannya asam dibagi menjadi dua jenis, adalah asam besar lengan berkuasa dan asam lemah. Kekuatan suatu asam dapat ditentukan dari kemampuannya melepaskan ion hidrogen yang bermuatan nyata (ion H⁺) saat dilarutkan dalam air. Semakin banyak ion H⁺ yang dilepaskan, semakin berpengaruh sifat asamnya. Berikut ini adalah tabel beberapa teladan asam besar lengan berkuasa dan asam lemah.
| No. | Nama Asam | Rumus Kimia | Kekuatan | Terkandung Dalam |
|---|---|---|---|---|
| 1. | Asam Klorida | HCL | Kuat | Dalam sistem pencernaan hewan dan insan |
| 2. | Asam Sulfat | H₂SO₄ | Kuat | Dalam aki mobil |
| 3. | Asam Nitrat | HNO₃ | Kuat | Sebagai salah satu materi pembuat pupuk |
| 4. | Asam Bromida | HBr | Kuat | Sebagai indikator terjadinya reaksi kimia |
| 5. | Asam Asetat | CH₃COOH | Lemah | Dalam cuka kuliner |
| 6. | Asam Sitrat | C₆H₆O₇ | Lrmah | Dalam buah jeruk |
| 7. | Asam Format | HCOOH | Lemah | Dalam gigitan semut dan sengatan lebah |
| 8. | Asam Karbonat | H₂BO₂ | Lemah | Dalam air hujan dan air soda |
| 9. | Asam Sianida | HCN | Lemah | Dalam umbi-umbian contohnya gadung |
2. Contoh-pola Basa
Sama halnya dengan zat asam, zat basa juga mampu dengan mudah kita temui dalam kehidupan sehari-hari. Sifat licin dan rasanya yang pahit merupakan cara gampang untuk mengenali zat basa. Beberapa pola zat basa yang sering digunakan ialah:
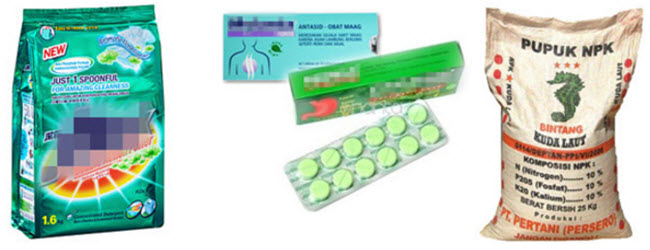
- Natrium hidroksida / soda api / soda ash dan kalium hidroksida, sebagai bahan baku pembersih dalam rumah tangga, contohnya sabun mandi, sabun basuh, detergen, pemutih dan pembersih lantai
- Magnesium hidroksida dan aluminium hidroksida, terkandung dalam obat nyeri lambung (antasid)
- Amoniak, untuk pelarut desinfektan (pencegah terjadinya jerawat) dan bahan baku pupuk urea
Sama seperti asam, basa juga dibedakan menjadi basa kuat dan basa lemah. Kekuatan suatu basa mampu ditentukan dari kemampuannya melepaskan ion hidroksida yang bermuatan negatif (ion OH⁻) saat dilarutkan dalam air. Semakin banyak ion OH⁻ yang dilepaskan, semakin besar lengan berkuasa sifat basanya. Semua rumus kimia basa umumnya mengandung gugus OH⁻.
Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida. Berikut ini tabel beberapa pola basa kuat dan basa lemah:
| No. | Nama Basa | Rumus Kimia | Kekuatan |
|---|---|---|---|
| 1. | Natrium Hidroksida | NaOH | Kuat |
| 2. | Kalium Hidroksida | KOH | Kuat |
| 3. | Magnesium Hidroksida | Mg(OH)₂ | Kuat |
| 4. | Kalium Hidroksida | Ca(OH)₂ | Kuat |
| 5. | Barium Hidroksida | Ba(OH)₂ | Kuat |
| 6. | Gas Amoniak | NH₃ | Lrmah |
| 7. | Amonium Hidroksida | NH₄OH | Lemah |
| 8. | Aluminium Hidroksida | Al(OH)₂ | Lemah |
| 9. | Besi (II) Hidroksida | Fe(OH)₂ | Lemah |
Secara lengkap, perbedaan asam dan basa disajikan pada tabel berikut!
| Perbedaan | Asam | Basa |
|---|---|---|
| Rasa | Masam | Pahit |
| Kertas lakmus biru | Memerahkan kertas lakmus biru | Tidak merubah warna |
| Kertas lakmus merah | Tidak merubah warna | Membirukan kertas lakmus merah |
| Sifat | Korosif | Kaustik |
| Reaksi dengan air | Menghasilkan ion H+ | Menghasilkan ion OH- |
| Contoh | Asam cuka, asam askorbat, asam klorida, dan asam semut | Soda kue, pasta gigi, dan Natrium hidroksida |
3. Contoh-teladan Garam
Salah satu cara memperoleh senyawa garam adalah dengan cara mereaksikan zat asam dengan zat basa. Reaksi ini dikenal dengan reaksi penggaraman atau disebut juga reaksi netralisasi. Dalam kehidupan sehari-hari garam yang sering dipakai antara lain:
garam dapur (NaCl), garam inggris (MgSO₄) sebagai obat pencahar, soda kue (NaHCO₃) sebagai pengembang roti, monosodium glutamat (MSG) sebagai penyedap rasa.
Sifat garam tergantung pada asam dan basa pembentuknya. Garam yang berasal dari reaksi antara asam dan basa mampu bersifat asam, basa atau netral.
- Garam yang bersifat asam, memiliki pH < 7, berasal dari reaksi antara asam besar lengan berkuasa dan basa lemah. Contoh: NH₄Cl (amonium klorida / salmoniak), dan NH₄NO₃ (amonium nitrat).
- Garam yang bersifat basa, memiliki pH > 7, berasal dari reaksi antara asam lemah dan basa berpengaruh. Contoh: KNO₂ (kalium nitrit), NaHCO₃ (natrium bikarbonat / soda kue), NaCH₃COO (natrium asetat), KCN (kalium sianida / potas), dan KF (kalium fosfat).
- Garam yang bersifat netral, memiliki pH = 7, berasal dari asam berpengaruh dan basa berpengaruh.
- Contoh: NaCl (natrium klorida), KI (kalium iodida), dan KNO₃ (kalium nitrat).
Reaksi penggaraman (netralisasi) sangat berguna bagi kehidupan insan. Dalam kehidupan sehari-hari banyak dijumpai pemanfaatan reaksi netralisasi, contohnya:
- Untuk mengurangi rasa sakit dan iritasi balasan sengatan lebah yang mengandung asam dipakai soda kue (natrium bikarbonat)
- Nyeri lambung akibat kadar asam klorida dalam lambung yang berlebihan dinetralisir dengan obat yang mengandung basa magnesium hidroksida atau aluminium hidroksida
- Limbah cair hasil industri yang dibuang ke sungai mengandung zat asam yang mampu menjadikan maut ikan oleh hasilnya ditambahkan aluminium hidroksida untuk menetralkannya
- Mulut kita mengandung zat asam sisa makanan dan minuman yang dapat merusak gigi dan menimbulkan busuk mulut, untuk menetralisirnya kita menggunakan pasta gigi yang mengandung zat basa
- Tanah yang terlalu asam akibat hujan asam dan tanah gambut, mampu menjadikan tanaman tidak mampu tumbuh dengan baik. Untuk mengatasinya tanah diberi senyawa yang bersifat basa, contohnya kalsium oksida, kalsium hidroksida atau kalsium karbonat sebelum ditanami.
Terima kasih telah membaca artikel di website kabarpandeglang.com, semoga bisa memberikan informasi yang bermanfaat bagi kamu dan bisa dijadikan referensi. Artikel ini telah dimuat pada kategori pendididkan https://kabarpandeglang.com/topik/pendidikan/, Jangan lupa share ya jika artikelnya bermanfaat. Salam admin ganteng..!!